A: ADN + ARN bactérie
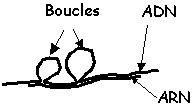
TD 4 : TRANSCRIPTION - TRADUCTION
EXERCICE 1
La séquence suivante correspond à un fragment d'ADN double brin :
5'-TTACACCATGTTAGAGGAGTCACATAGCTAACA-3'
3'-AATGTGGTACAATCTCCTTAGTGTATCGATTGT-5'
1. Donner les séquences des ARN qui pourraient résulter de la transcription de ce fragment.
2. Quels polypeptides peut-on obtenir lorsque l'on traduit ces ARN ? (le système de traduction nécessite un codon d'initiation).
3. Quel est selon toute vraisemblance le brin
codant ? Justifiez.
EXERCICE 2
Les formes actuelles de la protéine H sont apparues à la suite de mutations intervenant au cours de l'évolution. La séquence d'une des portions de cette protéine H est connue chez un animal dont les caractéristiques se rapprochent beaucoup de l'âne domestique (individu appelé "Esdé", têtu, violent, se déplaçant à quatre pattes...). Cette séquence a été comparée à celle de la protéine H de l'âne domestique :
21 22 23 24 25 26 27 28protéine HA de l'âne:NH2 Val Ala Leu Asn Ala Met Tyr Glu COOH
1. Quels types de mutations pourraient expliquer cette différence dans la séquence peptidique entre cet individu "Esdé" et l'âne domestique?
2. En vous aidant du code génétique (voir ci-dessous), retrouvez les séquences en nucléotides des ARN messagers qui codent pour cette région de la protéine H de ces deux individus aux nombreux points communs.
QUESTION 3
Le Lysozyme est une protéine qui a une masse moléculaire de 15 kDa (15000 daltons).
1. Sachant que la masse moléculaire moyenne d’un acide aminé est de 110 daltons, quelle est la taille (en acides aminés) de cette protéine ? (justifiez votre réponse)
2. Quelle est la longueur du cadre de lecture ouvert de l’ARN messager codant pour cette protéine ? (justifiez votre réponse).
3. Le gène du Lysozyme de poulet est constitué de 55 kpb (55000 paires de bases). Quelle est la proportion (en %) de cette séquence qui code pour la chaîne polypeptidique ? (justifiez votre réponse).
4. On s’aperçoit que, souvent, seule une faible proportion de la séquence nucléotidique d'un gène eucaryote est traduite en chaîne polypeptidique, expliquer en utilisant des schémas simples les raisons de ce phénomène.
EXERCICE 4
Des chercheurs purifient deux fragments d'ADN correspondants à deux gènes bactériens (FA et FB). Ils dénaturent leurs deux fragments d'ADN (dissocient les deux brins) en chauffant leurs préparations à 90°C. Dans les deux cas, ils purifient ensuite chacun des deux brins séparés par centrifugation sur un gradient de chlorure de césium. Ils obtiennent ainsi 4 préparations (FA-P1 et FA-P2) et (FB-P1 et FB-P2).
Ils préparent ensuite les ARN messagers de ces bactéries qu'ils mélangent avec leurs différentes préparations. Il peut ainsi se former des hétéroduplexes constitués d'un brin d'ADN et d'un brin d'ARN associés grâce aux complémentarités de séquences. Les différents résultats obtenus sont les suivants :
préparation utilisée |
Hétéroduplexes observés |
||
-ARN |
+ARN |
||
Exp. 1 |
FA-P1 |
- |
+ |
Exp. 2 |
FA-P2 |
- |
- |
Exp. 3 |
FB-P1 |
- |
- |
Exp. 4 |
FB-P2 |
- |
+ |
1. Comment expliquez-vous ce résultat ? quelles informations capitales vous donne cette expérience ?
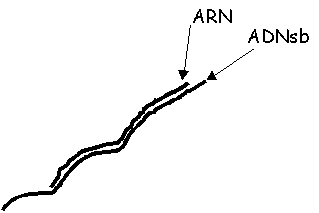
L'analyse les résultats de l'expérience 1 (avec ARN) en microscopie électronique montre clairement la présence d'hétéroduplexes ADN-ARN (voir figure 1A).
Une expérience similaire est réalisée à l'aide un fragment d'ADN et d'ARNm eucaryotes. Le type d'hétéroduplexe formé dans ce cas est présenté sur la figure 1B.
A: ADN + ARN bactérie |
B: Hétéroduplexes observés |
|
|
Figure 1
2. Analysez cette expérience. Comment l'expliquez-vous ?
EXERCICE 5
L'expérience suivante concerne la synthèse coordonnée des chaînes polypeptidiques a et b constitutives de l'hémoglobine. Elle a permis de déterminer le sens de la synthèse protéique. Des réticulocytes de lapin (globules rouges) ont été incubés en présence de lysine tritiée (3H-lysine) pendant 10 minutes, ce qui est très long comparé au temps nécessaire pour la synthèse d'une seule chaîne de globine.
Une centrifugation permet ensuite d'isoler les ribosomes, et les chaînes naissantes qui leur sont liées. La préparation ne contient pas les chaînes de globines solubles (complètes).
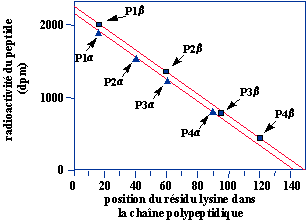
Les chaînes de globines naissantes subissent une digestion à la trypsine. Cette enzyme hydrolyse la liaison peptidique entre l'acide aminé lysine (ou arginine) et l'acide aminé qui le suit. Cette réaction libère donc différents peptides possédant à leur extrémité C-terminale une lysine ou une arginine. On sépare alors ces peptides par une chromatographie et on mesure leur radioactivité. La figure 1 présente le graphe de la radioactivité de différents peptides en fonction de la position du résidu lysine dans la chaîne polypeptidique.
 Figure
1.
Figure
1.
P1a , P2a , P3a et P4a : différents peptides obtenus après digestion des chaînes a .
P1b , P2b , P3b et P4b : différents peptides obtenus après digestion des chaînes b .
1. Après avoir légendé ce schéma, indiquez sur celui-ci à quoi correspondent les différents peptides P1a , P2a , P3a et P4a obtenus à l'issu de cette expérience.
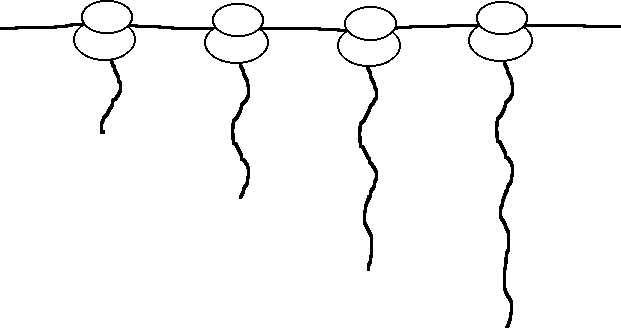
2. Ces données vous permettent-elles de déterminer quelle extrémité des chaînes de globine (NH2- ou COOH-terminale) est synthétisée la première ? Pourquoi ?
3. On sait par ailleurs que la production d'ARNm spécifiant les chaînes a est double de celle spécifiant les chaînes b . D'après les résultats de l'expérience, dans quelles proportions relatives les chaînes polypeptidiques a et b sont elles produites? Pourquoi ?.Quelle(s) conclusion(s) en tirez-vous?
CODE GENETIQUE
