Cet effet intéresse les doublets . Lorsque la liaison est formée entre deux éléments de nature différente, les électrons sont attirés vers l'élément le plus électronégatif.
On appelle ”effet inducteur négatif” -I les effets résultant du déplacement des électrons d'une liaison vers un atome plus négatif que le carbone, et effet inducteur positif +I les effets résultant de leur déplacement vers le carbone en s'éloignant d'un atome moins électronégatif que lui :
![]()
Ces effets sont à l'origine de la polarisation de la molécule. Un moment dipolaire apparaît : exemple des halogènes
1.1. Effet inducteur négatif -I.
Ceux-ci sont très forts pour les molécules présentant des charges positives complètes ; ils sont d'autant plus intenses que l'atome lié à C est plus électronégatif :
Dans ![]() , l'effet est plus intense que dans
, l'effet est plus intense que dans ![]() , lui-même plus fort que dans
, lui-même plus fort que dans ![]() .
.
Les effets restent forts même quand la charge est compensée par une charge négative voisine (liaison semipolaire) :
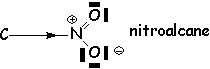

Pour les atomes non chargés, l'effet dépend de leur électronégativité :
![]()
Les effets inductifs sont additifs :
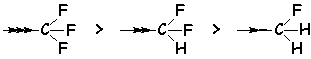
On trouve de même un effet inductif extrêmement fort pour :
![]()
Les groupes fonctionnels qui donnent lieu à une mésomèrie et dont au moins une forme limite présente une charge + exercent également un effet -I assez important :
![]()
L'état d'hybridation a aussi une influence :
![]()
1.2. Effet inductif positif +I.
Les atomes chargés + ont un fort effet +I : celui-ci decroît quand l'électronégativité croît.
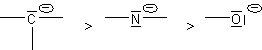
Plus l'atome non chargé est électropositif, plus l'effet +I est important :
![]()
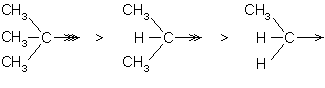
Les groupes alkyles ont un effet +I. Plus ils sont ramifiés, plus cet effet est important :