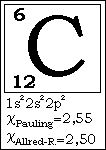
 Le
carbone de symbole atomique C est l'atome qui tient la place principale
dans le monde de la structure moléculaire des organismes vivant.
Le
carbone de symbole atomique C est l'atome qui tient la place principale
dans le monde de la structure moléculaire des organismes vivant.
Fort de quatre liaisons, sa tétravalence
lui confère une propriété fondamentale : être à la base d'un squelette
moléculaire stable.
Généralités sur
le carbone
Le carbone comme corps pur existe dans la nature
sous deux formes que sont le diamant et le graphite (charbon).
Les dérivés composés de carbone sont eux très nombreux : on
en dénombre aujourd'hui 15 millions. Les caractéristiques du
carbone sont un numéro atomique Z = 6 et une masse molaire moyenne
de : M(C) = 12 g / mol.
Le carbone
graphite
Le carbone graphite, c'est-à-dire le charbon,
est la forme la plus courante du carbone pur.
L'utilisation qui en est faite est celle de combustible.
La réaction de combustion transforme le carbone en dioxyde de
carbone grâce au dioxygène de l'air, avec un fort dégagement
d'énergie.
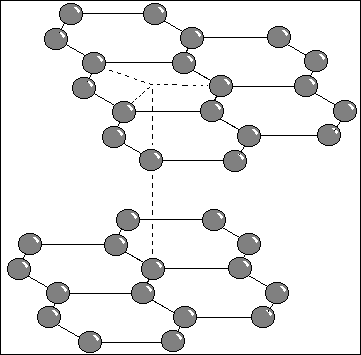
Le carbone graphite a une structure cristallographique
bien connue : c'est un assemblage hexagonal. La particularité
de l'assemblage est qu'il est lamellaire. Il y a en effet une
distance de 335 pm entre chaque feuillet, alors qu'à titre de
comparaison, le côté de chaque hexagone mesure 141,5 pm. Cette
structure lamellaire permet d'insérer des molécules ou des ions
: les composés d'insertion.
Le graphite existe aussi sous forme rhomboédrique.
L'énergie de liaison entre atomes de carbone dans
le graphite est de l'ordre de celle du benzène, à peu près 310
kJ / mol.
Question. Pourquoi le graphite
est-il noir ?
Réponse. La grande délocalisation
des électrons dans le réseau implique une absorption totale
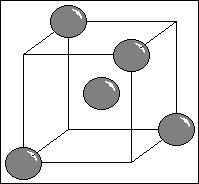 Le
carbone diamant
Le
carbone diamant
La dureté du diamant est la conséquence de deux
faits : une grande cohésion et une énergie de liaison entre
atomes de carbone très élevée : E(C-C)diamant = 360 kJ / mol.
Le diamant est une structure cubique face centrées,
où chaque carbone de la maille se trouve entourée de quatre
atomes de carbone selon un tétraèdre.
Les fullerènes
Les fullerènes sont des structures tout intermédiaires
entre le carbone diamant et le carbone graphite. Ils se présentent
sous la forme de sphères pouvant (composées uniquement de carbone)
se différenciant par le nombre d'atomes de carbones qui les
composent, par exemple le C60 (footbalène), C40,
C120...
De nombreuses recherches sont actuellement menées
pour leur trouver des applications industrielles.
Structure
de l'atome de carbone
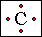 Dans
la classification de Mendeleiev, le carbone se trouve sur la
deuxième ligne, en sixième colonne, et porte le numéro atomique
Z = 6. La configuration électronique du carbone est donc K2L4
ou 1s2 2s2 2p2. Ceci implique
que quatre électrons non appariés peuvent créer des liaisons
: le carbone est tétravalent. Sa structure de Lewis est donc
la suivante :
Dans
la classification de Mendeleiev, le carbone se trouve sur la
deuxième ligne, en sixième colonne, et porte le numéro atomique
Z = 6. La configuration électronique du carbone est donc K2L4
ou 1s2 2s2 2p2. Ceci implique
que quatre électrons non appariés peuvent créer des liaisons
: le carbone est tétravalent. Sa structure de Lewis est donc
la suivante :
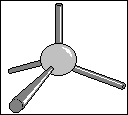 Le
carbone tétragonal
Le
carbone tétragonal
Les quatres liaisons du carbone peuvent être orientées
selon quatre directions différentes. L'angle entre chaque liaison
est de 109°28'.
On retrouve cette structure tétraédrique dans
les molécules de type alcanes, cyclanes, ainsi que dans les
groupements alkyles.
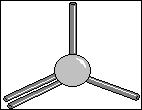 Le
carbone trigonal
Le
carbone trigonal
Les quatres liaisons du carbone peuvent être orientées selon
trois directions. Ceci implique deux liaisons simples et une
liaison double. On retrouve cette structure trigonale dans différentes
familles de molécules :
- avec un carbone : alcènes
- avec un oxygène : aldéhydes, cétones, acides carboxyliques
et dérivés
- avec un azote : imine
Le carbone trigonal est plan, et les angles entre liaisons
sont de 120°.
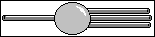
Le carbone digonal
Les quatres liaisons du carbone peuvent être orientées
selon deux directions. Il y a donc deux possibilités.
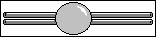
-
Deux doubles liaisons, que l'on retrouve dans
une molécule courante, le dioxyde de carbone (O=C=O), et
dans d'autres molécules plus rares, les isocyanates (O=C=N-),
les allènes(R=C=R').
 Le
carbone sp3
Le
carbone sp3
L'hybridation sp3 correspond à la géométrie
tridimenseionnelle du carbone tétraédrique.
 Le
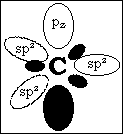
carbone sp²
Le
carbone sp²
L'hybridation sp² du carbone correspond à la géométrie
plane que l'on retrouve dans le carbone trigonal. Cette représentation
permet de représenter la double liaison selon la chimie quantique.
Bibliographie
- Dandonneau Y. 1998 - Le cycle du carbone
dans les océans - Dossier Pour la Science, 21,
Les humeurs de l'océan, p. 54-57.